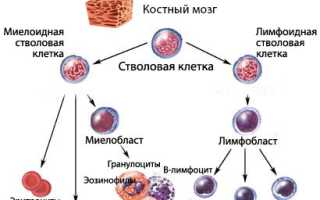
Коротко о гемопоэзе
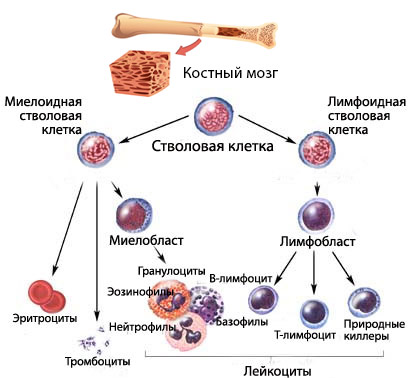
Кроветворение, или гемопоэз, — это многоступенчатый процесс, в ходе которого клетки крови получают новые характеристики (дифференцируются). В результате этого процесса в периферическую кровь поступают зрелые форменные элементы, обладающие необходимыми функциональными способностями:
- Эритроциты — красные кровяные тельца;
- Лейкоциты — белые клетки;
- Тромбоциты — кровяные пластинки (бляшки Биццоцеро).
Процесс кроветворения начинается со стволовой клетки, которая может дифференцироваться и давать начало всем линиям гемопоэза. Миелоидные и лимфоидные ростки формируются из специализированных клеток с высокой пролиферативной активностью и способностью к дифференцировке плюрипотентных клеток.
Нарушение кроветворения в миелоидном направлении приводит к тому, что аномальный клон теряет способность к воспроизводству, что снижает количество клеток данного ростка. Это негативно сказывается на созревании полноценных клеток. В результате уменьшается численность одной или нескольких популяций форменных элементов, а также ухудшается качество клеток, что отрицательно влияет на их функциональные возможности.
Таким образом, возникает группа гетерогенных патологических состояний, известная как миелодиспластический синдром.
Миелодиспластический синдром (МДС) представляет собой группу заболеваний, характеризующихся нарушением кроветворения и повышенным риском трансформации в острый миелоидный лейкоз. Врачи отмечают, что классификация МДС основывается на морфологических и цитогенетических характеристиках, что позволяет более точно оценить прогноз и выбрать оптимальное лечение.
Развитие синдрома может быть связано с воздействием химических веществ, радиации или генетическими предрасположенностями. Лечение МДС включает поддерживающую терапию, применение гипометилирующих агентов и, в некоторых случаях, трансплантацию костного мозга. Врачи рекомендуют регулярное наблюдение за пациентами, так как ранняя диагностика и индивидуализированный подход к терапии могут значительно улучшить качество жизни и увеличить продолжительность ремиссии. Прогноз зависит от многих факторов, включая возраст пациента, наличие сопутствующих заболеваний и генетические изменения в клетках.

Позиция МДС в Международной классификации болезней
Международная классификация болезней десятого пересмотра (МКБ-10), утвержденная Всемирной организацией здравоохранения (ВОЗ) в Женеве в 1989 году, начала действовать в России с 1997 года. В 2010 году в классификацию были внесены изменения, касающиеся множества патологий, включая гематологические заболевания, такие как миелодиспластический синдром (МДС). В рамках МКБ-10 МДС обозначается кодом D46 и входит в блок диагнозов D37-D48. В России, помимо классификации ВОЗ, могут применяться и другие системы, например, FAB, где представлено всего 5 вариантов, что может приводить к различиям в кодировании в разных справочниках.
- D0 Рефрактерная анемия (РА) без сидеробластов – характеризуется отсутствием бластов в периферической крови и дисплазией в костном мозге, затрагивающей в основном эритроцитарный росток. Содержит менее 5% бластов и менее 15% сидеробластов.
- D1 Рефрактерная анемия с кольцевыми сидеробластами – РАКС (в миелограмме – менее 5% бластов, но предшественники красных клеток не могут нормально переносить кислород из-за дефекта, связанного с кольцевыми отложениями железа).
- D2 Рефрактерная анемия с избытком бластов – РАИБ (в костном мозге до 20% миелобластов; классификация ВОЗ делит РАИБ на два подвида: РАИБ-I – до 10% бластов и РАИБ-II – до 20% бластов).
- D3 Рефрактерная анемия с избытком бластов с трансформацией – РАИБ-Т (миелограмма показывает до 30% бластов, что по классификации ВОЗ соответствует острому миелолейкозу – ОМЛ).
- D4 Рефрактерная анемия неуточненная.
- D5 Рефрактерная цитопения с мультилинейной дисплазией (РЦМД) – наблюдаются проблемы с созреванием клеток по двум и более направлениям, что приводит к снижению уровня гемоглобина и цитопении (уменьшение количества лейкоцитов и тромбоцитов). РЦМД является наиболее распространенной формой МДС (до 30%) и представляет собой серьезную угрозу из-за высокого риска трансформации в острый лейкоз.
- D6 Миелодиспластический синдром с изолированной del(5q) хромосомной аномалией – 5q-минус синдром (в периферической крови – анемия, нормальное количество тромбоцитов, менее 5% бластных форм, в костном мозге – менее 5% миелобластов, с изолированной del(5q)).
- D7 Другие миелодиспластические синдромы (например, хронический миеломоноцитарный лейкоз – ХММЛ, который в классификации ВОЗ обозначается как миелодиспластическое миелопролиферативное заболевание).
- D9 Миелодиспластический синдром неуточненный – предлейкоз (синдром) БДУ, миелодисплазия БДУ, МДС, связанный с терапией БДУ.
Примечание: термин «рефрактерная» в данном контексте указывает на неэффективность лечения препаратами, содержащими железо и витамины. Рефрактерная анемия не поддается таким мерам и требует применения других терапевтических подходов.
| Классификация МДС (по ВОЗ, 2016) | Ключевые характеристики и развитие | Лечение и рекомендации | Прогноз |
|---|---|---|---|
| МДС с однолинейной дисплазией: – Рефрактерная цитопения с однолинейной дисплазией (RCUD) – Рефрактерная анемия с кольцевыми сидеробластами (RARS) – Рефрактерная цитопения с многолинейной дисплазией и с избытком бластов-1 (RCMD-1) | – Преимущественно поражение одного ростка кроветворения (эритроидного, гранулоцитарного или мегакариоцитарного). – Медленное прогрессирование. – Низкий риск трансформации в ОМЛ. | – Поддерживающая терапия (трансфузии, стимуляторы кроветворения). – Лекарственная терапия (азацитидин, децитабин) в зависимости от симптомов и риска трансформации. – Мониторинг состояния. | – Переменчивый, зависит от подтипа и наличия симптомов. – Хороший прогноз при RCUD, худший при RCMD-1. |
| МДС с многолинейной дисплазией: – Рефрактерная анемия с избытком бластов-2 (RAEB-2) – Рефрактерная цитопения с многолинейной дисплазией (RCMD) | – Поражение нескольких ростков кроветворения. – Более быстрое прогрессирование, чем при однолинейной дисплазии. – Высокий риск трансформации в ОМЛ. | – Более агрессивное лечение, чем при однолинейной дисплазии. – Химиотерапия (гипометилирующие агенты, высокодозная химиотерапия с трансплантацией костного мозга). – Поддерживающая терапия. | – Хуже, чем при однолинейной дисплазии. – Зависит от стадии заболевания и ответа на лечение. |
| МДС с избытком бластов: – Рефрактерная анемия с избытком бластов-1 (RAEB-1) – МДС с избытком бластов (более 20% бластов в костном мозге) | – Значительное количество бластных клеток в костном мозге. – Быстрое прогрессирование. – Высокий риск трансформации в ОМЛ. | – Агрессивное лечение, часто включающее химиотерапию и/или трансплантацию костного мозга. – Поддерживающая терапия. | – Плохой прогноз. – Высокая вероятность трансформации в ОМЛ. |
| 5q-синдром | – Характеризуется делецией длинного плеча 5-й хромосомы. – Часто проявляется как рефрактерная анемия с кольцевыми сидеробластами. | – Лекарственная терапия (леналидомид). – Поддерживающая терапия. | – Относительно благоприятный прогноз по сравнению с другими подтипами МДС. |
Общая характеристика синдрома
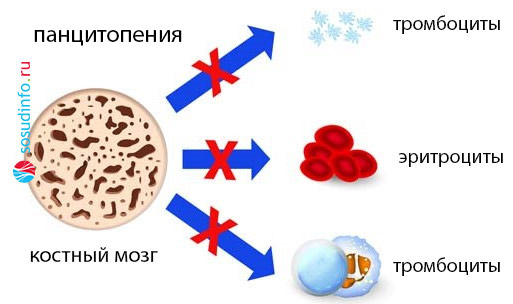
Аномалии в генетическом материале полипотентных стволовых клеток, отвечающих за кроветворение, и мутации в клетках-предшественниках могут привести к образованию генетически неполноценных клонов. Это вызывает значительные изменения в клеточном компоненте иммунной системы. Степень изменений зависит от того, какие линии кроветворения подверглись нарушениям — одной или нескольким. В зависимости от этого в крови могут наблюдаться следующие состояния:
- Моноцитопения (уменьшение количества одного типа клеток);
- Бицитопения (нарушения затрагивают два ростка);
- Панцитопения (сбой затрагивает три направления, что приводит к резкому снижению количества белых и красных кровяных клеток, а также тромбоцитов).
В костном мозге могут наблюдаться различные состояния: нормоклеточность, гиперклеточность или гипоклеточность (миелограмма поможет определить, какой росток пострадал).
Клинические проявления данного синдрома связаны с причиной, скрытой на уровне кроветворения:
- Анемия;
- Геморрагический синдром (при снижении количества и нарушении функции тромбоцитов);
- Сочетание анемического и геморрагического синдромов;
- Инфекционный синдром (реже);
- Увеличение селезенки, лимфаденопатия, постоянное повышение температуры тела (эти симптомы встречаются реже и считаются факультативными).
На основании множества исследований миелодиспластического синдрома (изменения в численности и морфологических характеристиках клеток крови и костного мозга) гематологи пришли к выводу, что миелодиспластический синдром может привести к острому или хроническому миелоидному лейкозу (ОМЛ или ХМЛ), а все рефрактерные анемии являются временным состоянием болезни. Поэтому миелодиспластический синдром часто называют «предлейкозом», «предлейкемией», «тлеющим» или «дремлющим» лейкозом. Это зависит от количества миелобластов — клеток-предшественников гранулоцитарного ряда.
Если рефрактерная анемия сопровождается избытком бластов (>20% по данным ВОЗ или >30% согласно классификации FAB), гематологи склоняются к диагнозу. Если количество бластных клеток не достигает этого порога, диагноз остается прежним.
Патологические изменения в главном органе кроветворения могут возникнуть в любом возрасте — от младенчества до глубокой старости. У детей заболевание чаще всего проявляется в возрасте от 3 до 5 лет, хотя риск заболевания в детском возрасте в целом низкий. Среди взрослых наиболее уязвимы пожилые люди (60 лет и старше). Например, рефрактерная цитопеническая миелодисплазия чаще встречается у людей в возрасте от 70 до 80 лет. Общая частота миелодиспластического синдрома составляет 3-5 случаев на 100 тысяч населения, причем мужчины страдают этой патологией несколько чаще, чем женщины.
Причины первичных форм заболевания остаются неясными. Основные возможные «виновники» вторичного миелодиспластического синдрома:
- Воздействие ионизирующего излучения;
- Влияние неблагоприятных антропогенных факторов окружающей среды (химических веществ);
- Последствия химио- и радиотерапии (после лечения опухолевых заболеваний);
- Инфекционные агенты (бактерии, вирусы).
Не было зафиксировано случаев наследственного миелодиспластического синдрома или его возникновения среди близких родственников. Однако наблюдения выявили группу пациентов с повышенным риском развития синдрома. Это дети и взрослые, страдающие синдромом Дауна, анемией Фанкони, а также синдромами Луи-Бар и Блума.
Миелодиспластический синдром (МДС) — это группа заболеваний, характеризующихся нарушением кроветворения в костном мозге. Люди, столкнувшиеся с этой проблемой, часто обсуждают классификацию МДС, которая включает несколько подтипов, таких как анемия, тромбоцитопения и нейтропения. Развитие синдрома может быть постепенным, и пациенты отмечают, что симптомы, такие как усталость и частые инфекции, могут быть неочевидными на ранних стадиях. Лечение МДС варьируется в зависимости от подтипа и тяжести заболевания и может включать химиотерапию, трансплантацию костного мозга и поддерживающую терапию. Многие пациенты делятся рекомендациями по образу жизни, включая правильное питание и регулярные обследования, что помогает улучшить качество жизни. Прогноз зависит от индивидуальных факторов, но ранняя диагностика и адекватное лечение могут значительно повысить шансы на благоприятный исход.

Лечатся все по-разному
Необходимо сразу предупредить пациента, что подход к лечению миелодиспластического синдрома (МДС) зависит от его разновидности. Комплекс терапевтических мероприятий разрабатывается индивидуально с учетом формы заболевания и уровня риска, определяемого по клинической классификации Международной Прогностической Системы (IPSS) для МДС: низкий, промежуточный 1 и 2, высокий. Врачи следуют определенным принципам перед началом лечения. Например:
- Пациенты младше 60 лет с минимальными проявлениями болезни, но отнесенные к промежуточной или высокой категории риска с прогнозируемой выживаемостью от 0,3 до 1,8 года, подвергаются интенсивному лечению.
- Люди из группы промежуточного и низкого риска с ожидаемой выживаемостью от 5 до 12 лет получают менее агрессивные методы терапии.
- Молодые пациенты и пациенты среднего возраста (до 60 лет) с хорошими показателями (ожидаемая выживаемость от полугода до 5 лет) начинают лечение по схемам низкой интенсивности, но могут перейти на более жесткие режимы (высокие дозы химиотерапии, пересадка костного мозга).
Таким образом, схемы лечения миелодиспластического синдрома являются сложными и известны только специалистам с соответствующей квалификацией (гематологам). В своей практике они опираются на рекомендации Британского комитета по стандартизации в гематологии (редакция 2009 года). Читателям будет достаточно ознакомиться с основными методами лечения, не углубляясь в детали и не относя себя или своих близких к определенной группе риска. Также полезно знать, что:
- Лечение высокой интенсивности включает обязательное пребывание в специализированном стационаре, назначение высоких доз химиотерапии и, возможно, подготовку к пересадке стволовых клеток.
- Низкоинтенсивная терапия предполагает периодическое пребывание в больнице (или в условиях дневного стационара) для получения заместительной терапии, низких доз химиопрепаратов и симптоматического лечения.
К сожалению, на сегодняшний день не существует способа полностью излечиться от такого серьезного заболевания, как МДС. Единственным решением может стать пересадка костного мозга, однако этот процесс сопряжен с трудностями (иммунологическое типирование, поиск совместимого донора, высокая стоимость операции, если искать донора за пределами страны). Тем не менее, в последние годы в России и Беларуси, а также в других странах бывшего СССР, открываются новые лаборатории тканевого типирования, которые объединяют свои реестры в единый банк для взаимопомощи. На них возлагаются надежды на будущее.
Лечение
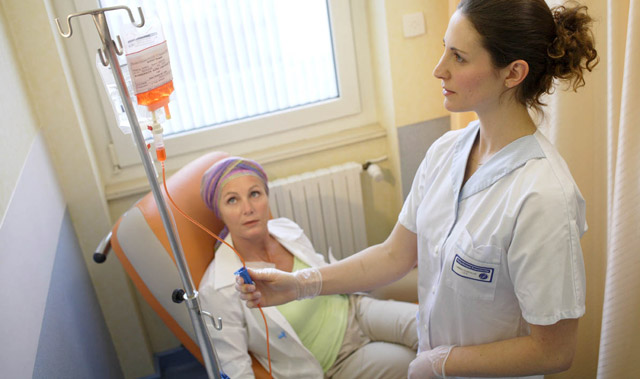
Если врач оценивает, что патологический процесс протекает относительно благоприятно и количество бластов невелико, пациенты из группы низкого риска, получающие заместительное и поддерживающее лечение (например, эритроцитарную массу и тромбовзвесь), могут долго продолжать работать и вести привычный образ жизни.
В основном:
- Пациент направляется в стационар для предотвращения значительного снижения уровня гемоглобина и развития тяжелого анемического синдрома. Борьба с этим синдромом (переливание эритроцитарной массы от доноров) считается первоочередной задачей.
- Учитывается и геморрагический синдром, возникающий из-за снижения количества и функциональной недостаточности тромбоцитов. Симптоматическая терапия, поддерживающая уровень форменных элементов (гемотрансфузии – эритроцитарная масса, тромбовзвесь и т. д.), всегда присутствует в схеме лечения пациентов с относительно благоприятной формой заболевания.
- При периодическом получении донорских эритроцитов организм может перегружаться железом, что устраняется с помощью медикаментов, образующих комплексы с этим элементом (например, эксиджад, десферол).
- В некоторых случаях назначаются низкие дозы химиотерапевтических препаратов (цитарабин, децитабин) и иммунодепрессивные средства для предотвращения иммунной агрессии против костного мозга (леналидомид), с добавлением ATG (антимоноцитарный глобулин) и циклоспорина.
- Присоединение инфекционного агента требует лечения антибиотиками и противогрибковыми средствами.
Когда химиотерапевтические препараты не дают ожидаемого результата и не обеспечивают долгосрочную ремиссию, это не означает полного отказа от них. Новые, недавно разработанные лекарства вызывают надежду в лечении МДС и даже применяются для терапии острого миелобластного лейкоза (ОМЛ). Однако существуют рекомендации использовать подобные средства для лечения пациентов младше 60 лет с хорошим иммунологическим статусом, иначе возрастает риск серьезных осложнений, способных привести к преждевременной смерти.
Пересадка стволовых клеток (возможна также только до 60 лет) на сегодняшний день является единственным способом избавить человека от страданий на долгие годы. К сожалению, трансплантация костного мозга – это операция, хоть и несложная с технической точки зрения, но трудная в плане подбора совместимого донора по лейкоцитарной системе HLA. Идентичными, то есть имеющими абсолютно одинаковый набор генов, являются только однояйцевые близнецы – идеальные доноры друг для друга.

Частные симптомы и диагностика
Клинические проявления миелодиспластического синдрома (МДС) и их выраженность варьируются в зависимости от форм заболевания. Случайная диагностика МДС встречается редко, обычно это происходит, когда пациент чувствует себя хорошо, а анализы назначаются по другим причинам. Чаще всего пациенты обращаются в поликлинику с конкретными жалобами, такими как постоянная усталость, одышка, физическая слабость, головокружение и частые повышения температуры. После анализа крови становятся заметными и другие признаки МДС:
- Цитопения (снижение количества нормальных форменных элементов крови);
- Анемия (пониженный уровень гемоглобина и недостаток эритроцитов), вызывающая симптомы, побуждающие обратиться к врачу;
- Нейтропения (недостаток нейтрофильных лейкоцитов, отвечающих за борьбу с инфекциями, что приводит к частым инфекциям и лихорадке);
- Тромбоцитопения (уменьшение количества тромбоцитов, что может вызвать геморрагический синдром — кровотечения, мелкие подкожные кровоизлияния и синяки).
Некоторые пациенты могут длительное время не подозревать о проблемах со здоровьем, и МДС может быть выявлен случайно при общем анализе крови.
Наиболее частой причиной обращения к врачу являются жалобы, связанные с анемией. Попытки повысить уровень гемоглобина и количество эритроцитов с помощью препаратов железа и витаминов, как правило, не приносят результатов, так как анемия при МДС является рефрактерной. При подозрении на МДС, выявленном в ходе общего анализа крови, назначаются дополнительные исследования:
- Подсчет молодых форм эритроцитов (ретикулоцитов), указывающий на скорость производства новых зрелых клеток;
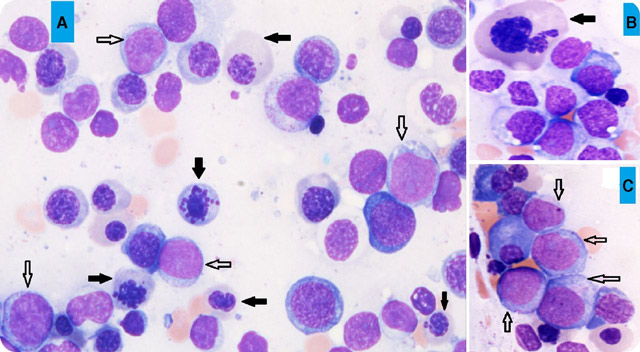
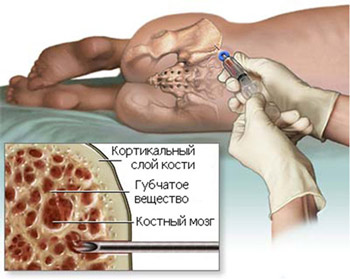
- Цитологическое исследование аспирата костного мозга (для пожилых пациентов этот тест не является обязательным);
- Трепанобиопсия (обязательная процедура для всех пациентов) — гистологический анализ, помогающий подтвердить или опровергнуть подозрения;
- Цитогенетическое исследование (так как МДС часто связано с хромосомными аномалиями), позволяющее выявить аномальный клон, если он существует, и подтвердить его влияние на процесс кроветворения; в противном случае картина МДС может быть вызвана каким-либо реактивным состоянием.
Диагностика миелодиспластического синдрома начинается с жалоб пациента и общего анализа крови, но затем требует более сложных лабораторных исследований. Врач должен тщательно оценить нарушения кроветворения, так как изменения в клеточном составе и морфологических характеристиках клеток крови и костного мозга могут быть весьма разнообразными. Как и само заболевание…
Прогноз и рекомендации
Прогноз по продолжительности жизни при миелодиспластическом синдроме не слишком обнадеживающий. Однако многое зависит от типа заболевания, уровня риска и возраста пациента. В целом, те, кто строго соблюдает предписания врача и регулярно получает поддерживающую терапию, могут рассчитывать на жизнь в течение пяти, а иногда и десяти лет. При активном течении злокачественной формы болезни шансы на выживание значительно снижаются. Если не удастся найти донора для пересадки стволовых клеток, жизнь может завершиться через 1-2 года после начала заболевания. Основной причиной смерти в таких случаях становится острый миелоидный лейкоз, развивающийся на фоне вторичного миелодиспластического синдрома.
Тем, кто столкнулся с этой проблемой и хочет продлить свою жизнь или жизнь близких, следует быть осторожными. Не стоит доверять рекомендациям людей, которые черпают информацию о болезнях из ненадежных источников, доступных в Интернете, и считают себя специалистами. Ни народные средства, ни специальные физические упражнения не способны вылечить миелодиспластический синдром. Важно следовать указаниям врача, чтобы повысить вероятность успешного лечения.
Видео: МДС и его отличие от анемии и лейкоза
Видео: лекция о лечении МДС
Вопрос-ответ
Как лечить миелодиспластический синдром?
Трансплантация стволовых клеток. На сегодняшний день единственным способом, позволяющим полностью победить МДС, является сочетание высокодозной химио- и/или лучевой терапии и пересадки стволовых клеток, из которых образуются новые клетки крови.
От чего умирают при миелодиспластическом синдроме?
Пациенты могут погибнуть как от проявлений самого МДС, так и от развившегося на его основе острого миелоидного лейкоза.
Что такое миелодиспластический синдром?
Миелодиспластический синдром – нарушение функции гемопоэтических стволовых клеток, приводящее к клональной пролиферации аномальных гемопоэтических стволовых клеток. Заболевание обычно проявляется анемией (чаще всего), лейкопенией и/или тромбоцитопенией. Часто развивается трансформация в острый миелолейкоз.
Советы
СОВЕТ №1
Изучите классификацию миелодиспластического синдрома (МДС), чтобы лучше понимать свое состояние. Это поможет вам и вашему врачу выбрать наиболее подходящий план лечения и следить за прогрессом заболевания.
СОВЕТ №2
Обсуждайте все возможные варианты лечения с вашим врачом. МДС может требовать индивидуального подхода, и важно рассмотреть все доступные методы, включая химиотерапию, трансплантацию костного мозга и поддерживающую терапию.
СОВЕТ №3
Регулярно проходите обследования и анализы крови. Это поможет отслеживать изменения в состоянии вашего здоровья и своевременно реагировать на возможные осложнения или прогрессирование заболевания.
СОВЕТ №4
Поддерживайте здоровый образ жизни, включая сбалансированное питание и физическую активность, по мере возможности. Это поможет укрепить вашу иммунную систему и улучшить общее самочувствие во время лечения.