Тромбофилия может быть запрограммированной
Существует мнение, что многие формы этого заболевания имеют врожденный характер, то есть они заложены в генетическом коде еще до рождения. Важно различать несколько аспектов:
- Генетическую предрасположенность, при которой болезнь может не проявиться без определенных факторов, способствующих её развитию.
- Заболевание, возникающее из-за мутации генов на ранних стадиях эмбрионального развития и затем становящееся наследственным, передаваясь следующим поколениям.
- Наследственное заболевание, вызванное геномными и структурными мутациями хромосом в предыдущих поколениях и передающееся по наследству.
В этом контексте важно учитывать состояние гена, вызывающего болезнь: доминантное или рецессивное (полиморфизм генов). При доминантном состоянии патология проявится независимо от того, является ли организм гомо- или гетерозиготой. Рецессивное состояние гена проявляется только при наличии двух слабых аллелей, формирующих гомозиготу.
Гетерозиготные организмы с патологическим геном в рецессивном состоянии зачастую не испытывают негативных последствий и иногда оказываются более устойчивыми и жизнеспособными по сравнению с нормальными особями. Тем не менее, полиморфизм генов (разные варианты генов — как патологические, так и нормальные) проявляется по-разному в зависимости от конкретного заболевания и требует тщательного изучения. В отношении тромбофилии проводятся исследования, которые помогают оценить риск тромбозов при полиморфизме определенных генов.
Чтобы читателю стало яснее, как формируется врожденная тромбофилия, стоит подробнее рассмотреть некоторые генетические аспекты, такие как понятие «генная мутация».
Врачи отмечают, что тромбофилия представляет собой группу состояний, связанных с повышенной склонностью к образованию тромбов. Генетическая составляющая играет ключевую роль в развитии этого заболевания, так как многие пациенты имеют наследственные мутации, влияющие на систему гемостаза. Существуют различные виды тромбофилии, включая антифосфолипидный синдром и наследственные формы, такие как мутации гена фактора V Лейдена и протеина C. Лечение тромбофилии обычно включает антикоагулянтную терапию, которая помогает снизить риск тромбообразования. Врачи подчеркивают, что важно учитывать индивидуальные риски, так как тромбофилия может привести к серьезным осложнениям, таким как тромбоз глубоких вен или легочная эмболия. Регулярное наблюдение и профилактика играют важную роль в управлении этим состоянием.
Мутация генов
На практике гены оказались менее стабильными и неизменными, чем считалось ранее. Они изменяются с различной частотой (от 10^-2 до 10^-5 в среднем), что приводит к появлению новых признаков, которые не всегда полезны. Это явление называется мутацией, и в контексте тромбофилии оно считается негативным.
К мутациям генов и, следовательно, к увеличению случаев наследственных заболеваний могут способствовать определенные факторы, концентрация которых в последнее время значительно возросла. Появлению аллелей, негативно влияющих на здоровье, содействует деятельность человека:
- Техногенные катастрофы;
- Загрязнение окружающей среды (пестициды, различные виды топлива, бытовая химия);
- Употребление медикаментов, пищевых добавок и генетически модифицированных продуктов;
- Радиационное излучение.
Мутагенез является случайным процессом, поскольку невозможно заранее предсказать, какой именно ген изменится в неблагоприятных условиях. Также неизвестно, в какую сторону произойдут изменения. Мутационный процесс происходит самостоятельно, изменяя наследственные характеристики. На примере тромбофилии можно утверждать, что эти изменения не всегда ведут к положительным результатам.
| Аспект Тромбофилии | Описание | Риски и Осложнения |
|---|---|---|
| Возникновение | Наследственные мутации генов, влияющие на свертываемость крови; приобретенные состояния (беременность, травмы, операции, длительная иммобилизация, онкологические заболевания, прием гормональных контрацептивов) | Тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии (ТЭЛА), инсульт, инфаркт миокарда, преэклампсия, задержка внутриутробного развития плода, невынашивание беременности |
| Генетическая составляющая | Мутации в генах, кодирующих факторы свертывания крови (например, фактор V Лейдена, фактор II), ингибиторы фибринолиза (например, мутация гена PAI-1), другие гены, влияющие на систему гемостаза | Повышенный риск тромбозов на протяжении всей жизни, более высокая вероятность развития тромбозов в молодом возрасте, семейный анамнез тромбозов |
| Виды (наследственные) | Дефицит антитромбина III: снижение активности ингибитора свертывания; Дефицит протеина С: снижение активности ингибитора факторов Vа и VIIIа; Дефицит протеина S: снижение активности кофактора протеина С; Мутация фактора V Лейдена: повышенная устойчивость фактора Vа к инактивации; Мутация протромбина G20210A: повышенная продукция протромбина | Зависит от конкретного типа тромбофилии и степени выраженности дефекта; более высокий риск тромбозов при наличии нескольких мутаций |
| Виды (приобретенные) | Антифосфолипидный синдром (АФС), тромбоз, связанный с онкологическими заболеваниями, тромбоз, связанный с беременностью (преэклампсия, HELLP-синдром), тромбоз, связанный с длительной иммобилизацией | Зависит от основного заболевания и сопутствующих факторов; риск тромбозов может быть высоким и быстро прогрессировать |
| Лечение | Профилактическое лечение (антикоагулянты, например, варфарин, гепарин, новые оральные антикоагулянты (НОАК)); лечение острых тромбозов (тромболитики, антикоагулянты); изменение образа жизни (физическая активность, отказ от курения); лечение сопутствующих заболеваний | Снижение риска развития тромбозов и их осложнений; предотвращение рецидивов; улучшение прогноза |
Полиморфизм генов и его значение в акушерской практике
Беременность значительно увеличивает риск тромбообразования, особенно у женщин с предрасположенностью или наследственными заболеваниями. Поэтому перед планированием беременности важно изучить свою родословную. Выявлены гены, связанные с тромбофилией, которые могут способствовать образованию тромбов во время беременности, родов и в послеродовом периоде. Наиболее значимыми из них являются:
- Полиморфизм гена фактора протромбина FII (G20210A) может привести к бесплодию, нарушениям внутриутробного развития и гибели плода, а также к гестозу, тромбоэмболиям, тромбозам, инфаркту миокарда и ишемической болезни сердца.
- Полиморфизм гена фактора Лейдена FV (G1691A) во время беременности может вызывать выкидыши и негативно сказываться на развитии плода, а также приводить к инфаркту миокарда, ишемическому инсульту и тромбоэмболиям.
- Мутация гена PAI-1 (SERPINE1) снижает активность противосвертывающей системы, что делает её ключевым компонентом.
- Роль мутации гена MTHFR C677T в тромбообразовании еще не полностью изучена, хотя исследуется более десяти лет. Доказано, что она негативно влияет на сосуды, способствуя образованию тромбов.
Эти и другие факторы, такие как гены ITGA2 и ITGB3, которые определяют повышенную агрегацию тромбоцитов, аномалии FGB (фибриногена), дефицит антитромбина III и недостаток белков С и S, относятся к наследственным патологиям и считаются маркерами тромбофилии.
Тромбозы и тромбоэмболии представляют серьезную угрозу во время беременности, так как могут привести к высокой материнской смертности и гибели плода. Поэтому заранее принятые меры будут полезны. Роды при тромбофилии, как правило, происходят раньше срока (на 35-37 неделе).
Наличие генетической карты может быть полезно и для других людей, особенно для профилактики осложнений, связанных с повышенным образованием тромбов (инфаркты, тромбоэмболия легочной артерии и др.). Определение генетических маркеров стало распространенным в кардиологии и акушерской практике. Основаниями для назначения анализа на тромбофилию являются:
- Планирование беременности;
- Наличие тромбозов в анамнезе;
- Случаи тромбозов, тромбоэмболий и летальных исходов в семье;
- Выкидыши и бесплодие.
Помимо акушерства, где риск развития патологии наиболее высок, кардиогенетика помогает избежать тромботических осложнений в хирургии (травмы, операции), онкологии (химиотерапия) и кардиологии (ишемическая болезнь сердца, инфаркты миокарда и головного мозга, артериальная гипертензия). Дополнительную группу риска могут составлять:
- Пациенты с варикозным расширением вен нижних конечностей;
- Люди с избыточным весом;
- Женщины, принимающие гормональные оральные контрацептивы;
- Работники, занимающиеся тяжелым физическим трудом.
Кардиогенетика позволяет выявить генетические аномалии в системе гемостаза и их полиморфизм, что указывает на предрасположенность к тромбозам. Это достигается с помощью анализа на молекулярно-генетическом уровне, который обычно выполняется с использованием ПЦР-диагностики (полимеразной цепной реакции).
Тромбофилия — это состояние, при котором повышается склонность к образованию тромбов в кровеносных сосудах. Многие люди не осознают, что генетическая предрасположенность играет ключевую роль в возникновении этого заболевания. Наследственные факторы, такие как мутации в генах, отвечающих за свертываемость крови, могут значительно увеличить риск тромбообразования. Существуют различные виды тромбофилии, включая антифосфолипидный синдром и наследственные формы, такие как мутация гена FV Leiden. Лечение часто включает антикоагулянтную терапию, которая помогает предотвратить образование тромбов. Однако важно помнить, что тромбофилия может привести к серьезным осложнениям, таким как тромбоз глубоких вен или легочная эмболия, что подчеркивает необходимость регулярного медицинского наблюдения и своевременной диагностики.

Формы и группы тромбофилий
Помимо врожденных патологий, существует также приобретенная форма, причины которой часто связаны с неблагоприятными условиями окружающей среды, использованием определенных медикаментов, чрезмерным увлечением биологически активными добавками и крупными плодами, привезенными из стран с неограниченной генной инженерией.
Как наследственные, так и приобретенные патологии системы гемостаза имеют общую природу — это изменение свойств крови, нарушающее гемостаз и способное привести к тромбозам и тромбоэмболиям. В группе гематогенных тромбофилий выделяются формы, вызванные изменениями в соотношении коагулянтов и ингибиторов, а также другими факторами, влияющими на гемостатическую систему.
Нарушение реологических свойств крови проявляется в снижении кровотока в капиллярах, увеличении количества эритроцитов свыше 5,5 × 10^12/л и патологических изменениях красных кровяных клеток. К этой категории заболеваний относятся:
- Эритремия (полицитемия) и эритроцитозы;
- Сгущение крови и другие случаи повышения гематокрита;
- Парапротеиемия (например, миеломная болезнь), сопровождающаяся увеличением вязкости крови, или гиперфибриногенемия, представляющая опасность для беременных женщин и плода;
- Инфаркты и тромботические кризы, возникающие из-за нарушенного кровообращения, связанного с изменениями в структуре и внешнем виде красных кровяных клеток.
Патологические изменения, ухудшение функциональных возможностей и повышенное содержание тромбоцитов объединяют наследственные гипертромбоцитозы и приобретенные формы гиперагрегации. Они могут возникать на фоне:
- Злокачественных новообразований;
- Избыточной продукции фактора Виллебранда в стенках сосудов;
- Снижения уровня стимулятора синтеза простациклина, мощного ингибитора агрегации тромбоцитов;
- Перенасыщения плазмы стимулирующими компонентами или их нехватки (тромботическая тромбоцитопеническая пурпура).
Недостаток или аномальное состояние естественных антикоагулянтов (белки С и S, антитромбин III, элементы фибринолитической системы) или высокое содержание их ингибиторов также представляют собой отдельную категорию гематогенной тромбофилии.
Кроме того, выделяются группы врожденных аномалий фибриногена (дисфибриногенемия) и тромбофилии иммуногуморального характера, к которым относится антифосфолипидный синдром (АФС), вызванный высокой концентрацией антител к фосфолипидам в крови (антикардиолипин, «волчаночный» антикоагулянт).
Отдельно стоит упомянуть ятрогенные тромбофилии, возникающие в результате лечения (неконтролируемого или некомпенсированного).
Когда не хватает AT III или протеинов С и S
Недостаток антитромбина III, который составляет около 80% всей антикоагулянтной активности, может быть наследственным или приобретенным. Вторичный дефицит возникает из-за снижения его продукции или чрезмерного потребления в процессе коагуляции. Это состояние наблюдается в следующих ситуациях:
- ДВС-синдром;
- Беременность, особенно с токсикозом, а также у людей с группой крови А(II);
- После хирургических вмешательств, при которых нарушается целостность сосудистой стенки;
- При некоторых новообразованиях;
- В результате длительной антикоагулянтной терапии;
- При болезни Бехчета;
- При использовании комбинированных оральных контрацептивов (КОК).
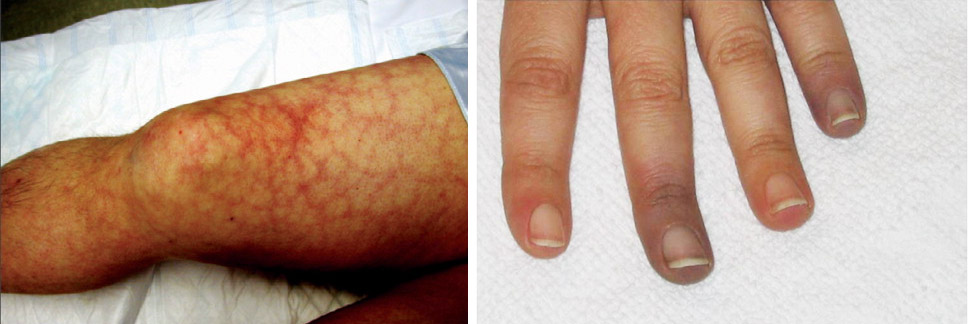
Основные проявления недостатка АТ III — тромбозы, которые могут проявляться по-разному. Тяжелая форма дефицита часто не позволяет дожить до подросткового возраста и характеризуется:
- Постоянными рецидивами тромбообразования в периферических и висцеральных венах, а также в сосудах сердца и головного мозга;
- Тромбоэмболиями, в частности, в легочной артерии.
Существует также менее тяжелая, но все же неблагоприятная форма, которая проявляется в возрасте 15-25 лет и может сопровождаться инфарктами в различных органах, особенно в легких и миокарде.
Пограничная форма не характеризуется спонтанными тромбозами, однако при определенных условиях (неподвижность, роды, послеоперационный период, травмы) риск развития тромбоэмболии легочной артерии значительно возрастает.
Потенциальная форма практически не проявляется спонтанными тромбозами, и ее симптомы обычно возникают в условиях, способствующих заболеванию. Например, беременность может стать триггером для начала болезни.
Основной метод лечения данной формы тромбофилии — заместительная терапия. Наилучшим образом подходят трансфузии концентрата АТ III и свежезамороженной плазмы, так как применение гепарина дает лишь незначительный эффект. Также могут назначаться гормоны, тромболитики и препараты, снижающие протромбиновый индекс (ПТИ).
Недостаток белков С и S, которые синтезируются в печени с участием витамина К, по своим характеристикам схож с дефицитом АТ III. Он может быть как наследственным, так и вторичным (например, при заболеваниях печени, механической желтухе, нехватке витамина К или длительном применении антикоагулянтов в больших дозах). Для этой патологии характерны симптомы политромботического синдрома, когда тромбозы возникают как в венозных, так и в артериальных сосудах.
Клинические проявления дефицита протеинов могут включать:
- Некрозы кожи;
- Гангрену, которая может возникать в различных участках тела, иногда не связанных между собой (от губ и ушей до мошонки и молочных желез);
- Злокачественную пурпуру у новорожденных, которая может развиться на фоне ДВС-синдрома при врожденной нехватке протеина С.
Диагностика данной патологии заключается в определении уровня белков С и S в плазме.
Лечебная стратегия включает устранение причин патологии, трансфузии свежезамороженной плазмы, введение гепарина и концентратов белков.

Аномальные состояния протромбина, фактора Лейдена (FV) и фибриногена, нарушение фибринолиза
Патология, возникающая из-за наследственной аномалии фактора Лейдена (резистентность активированного FV к протеину С), довольно распространена и проявляется предрасположенностью к тромбообразованию, включая рецидивирующие тромбозы.
Аномалии фибриногена, возникающие на молекулярном уровне, также относятся к наследственным заболеваниям и характеризуются повышенным тромбообразованием. Однако они сочетают два, на первый взгляд, противоположных процесса: тромбофилию и гипокоагуляцию. Это проявляется в удлинении времени свертывания и/или замедлении фибринолиза.
Нарушения фибринолиза можно разделить на два типа: наследственные (связанные с нарушением продукции активатора плазминогена или самого плазминогена, молекулярные аномалии) и приобретенные. Приобретенные нарушения могут возникать при вторичном дефиците, связанном с диссеминированным внутрисосудистым свертыванием, обширными тромбозами или лечением препаратами, активирующими фибринолиз. К факторам, способствующим развитию такой формы тромбофилии, относятся:
- Повреждение эндотелия в результате травм или хирургических вмешательств;
- Беременность у женщин с предрасположенностью или по другим причинам, а также роды.
Лечение включает плазмозамещение, которое комбинируется с инфузиями гепарина и плазминогена, а также активацию фибринолиза. Для профилактики тромбозов назначаются анаболические гормоны.
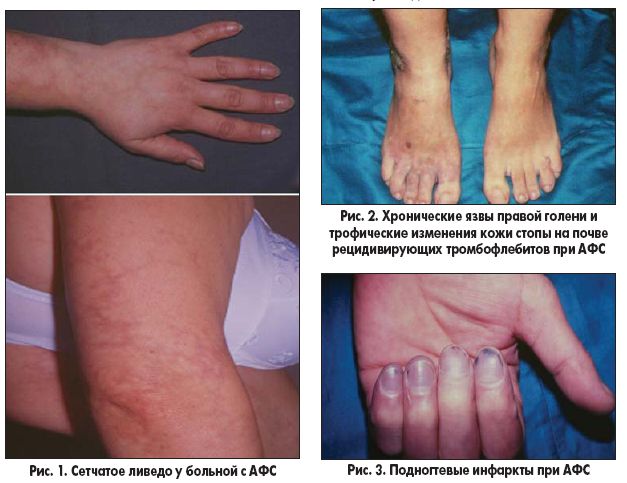
АФС – синдром, заслуживающий особого внимания
Совсем недавно о антифосфолипидном синдроме (АФС) было известно крайне мало. Его диагностика представляет собой сложную задачу, так как АФС часто сопровождает вирусные и иммунные заболевания, но может возникать и без видимых причин.
Наличие «волчаночных» антикоагулянтов в крови повреждает фосфолипидные мембраны клеточных оболочек, включая сосудистую стенку и тромбоциты, нарушая взаимодействие факторов свертывания. Эти антикоагулянты обладают следующими свойствами:
- Уменьшают противоагрегационные характеристики сосудистых стенок и тромборезистентность;
- Блокируют инактивацию тромбина тромбомодулином;
- Снижают выработку активаторов фибринолиза и простациклина в стенках сосудов;
- Увеличивают спонтанную агрегацию тромбоцитов.
Эти изменения вызывают реакцию гемостаза, проявляющуюся сочетанием различных симптомов: как кровоточивостью, так и тромбоэмболиями. Это может привести к ДВС-синдрому и нарушению кровообращения в головном мозге или других органах, таких как почки.
Сегодня гинекологи уделяют особое внимание антифосфолипидному синдрому, так как он вызывает множество проблем у женщин, стремящихся завести ребенка. Часто такие попытки заканчиваются выкидышами или мертворождением из-за тромбозов плацентарных сосудов. Кроме того, АФС может проявляться положительной реакцией на сифилис, что вызывает у пациентов значительное беспокойство.
К основным симптомам антифосфолипидного синдрома относятся:
- Повторяющиеся тромбозы в сосудах органов (легкие, почки, печень, головной мозг) и крупных сосудах;
- Нарушение микроциркуляции с проявлениями кровоточивости;
- Увеличение спонтанной агрегации тромбоцитов, что может сопровождаться тромбоцитопенией или протекать без нее;
- Проблемы с кровотоком в микроциркуляторном русле головного мозга, что может вызывать церебральные и психоневрологические расстройства (частые головные боли, частичную утрату подвижности конечностей, очаговую ишемию мозга, неврастению);
- Изменения в анализах крови (повышение СОЭ и иммунологических показателей).
В настоящее время многим женщинам назначают обследование для выявления АФС, особенно если у них есть отягощенный акушерский анамнез. Диагностика АФС основывается на определении уровня специфических антител и анализе коагулограммы.
Лечение зависит от типа антифосфолипидного синдрома (первичный или вторичный) и включает: плазмозамену, назначение дезагрегантов (аспирин, курантил), антикоагулянтов (гепарин), гормонов (преднизолон) и других препаратов.
Беременные женщины с АФС находятся под наблюдением гинекологов, которые следуют разработанным схемам лечения на каждом этапе беременности. Также назначается специальная диета, способствующая нормализации свертываемости крови.
Будущим мамам рекомендуется ограничить употребление таких полезных в других ситуациях продуктов, как белокочанная капуста, бананы, ягоды шиповника, клюквы и рябины, грецкие орехи, шпинат, укроп и петрушка. О жирном мясе и сале лучше забыть. В то же время полезно помнить, что морепродукты, свекла, гранат, лимоны, томаты, вишня и малина способствуют снижению свертываемости крови. Использование народных средств, например, мед с подсолнечным маслом (1 ч. ложка масла + 1 ст. ложка меда ежедневно), может помочь предотвратить повышенное тромбообразование.
Обмен веществ и тромбоэмболия
При различных заболеваниях врачи часто назначают коагулограмму, но многие пациенты не понимают её необходимость. Большинство хронических заболеваний связано с наследственными или приобретёнными нарушениями обмена веществ, которые могут привести к серьёзным осложнениям. Почему повышенные уровни липидного обмена, такие как холестерин и липидный спектр (гиперхолестеринемия), вызывают особое внимание? Почему сахарный диабет занимает важное место среди других болезней? Эти показатели сигнализируют о высоком риске сердечно-сосудистых заболеваний, которые могут привести к тромбозам, тромбоэмболиям и инфарктам, а также облитерирующим артериальным заболеваниям.
Опасным является также нарушение обмена серосодержащих аминокислот, таких как гомоцистеин и метионин. Изменение метаболизма этих белковых компонентов называется гипергомоцистеинемией (ГГЦ), которая может быть первичной (генетической) или вторичной (приобретённой, симптоматической). Врожденная форма ГГЦ проявляется в детском или подростковом возрасте, тогда как приобретённая чаще встречается у людей старшего возраста.
Научные исследования подтверждают, что гипергомоцистеинемия всегда связана с высоким риском развития и прогрессирования облитерирующих заболеваний артерий и сосудистых тромбозов.
Основным методом диагностики метаболических тромбофилий является определение уровня гомоцистеина в крови и моче пациента. Этот показатель значительно увеличивается при проведении пробы с нагрузкой метионином, который содержится в молочных продуктах. Диагностика также включает комплексное обследование пациента, включая ЭКГ, УЗИ, биохимический анализ крови и другие исследования в зависимости от клинической ситуации.
Лечение метаболических тромбофилий начинается с диеты, ограничивающей потребление продуктов, богатых серосодержащими аминокислотами. Это касается молока и его производных, а также мяса, рыбы, бобовых и сои. Пациент должен быть готов к длительному приёму витаминов группы В, комбинированных препаратов (например, Магне-В6) и фолиевой кислоты.
Лечение приводит к тромбозам?
Побочные эффекты многих медикаментов могут приводить к повышенной склонности крови к образованию тромбов. К таким препаратам относятся эстрогенные контрацептивы и некоторые группы цитостатиков. Парадоксально, но в этот список попадает и гепарин, который у некоторых пациентов может вызывать спонтанное склеивание тромбоцитов (гепариновая тромбофилия с рикошетными тромбозами). Также тромболитики, применяемые в больших дозах, могут истощать плазминовую систему и способствовать тромбообразованию за счет агрегации.
Тромбоцитопения, возникающая на 2-3 день лечения гепарином, называется ранней. Поздняя тромбоцитопения проявляется примерно через 1-1,5 недели и характеризуется более выраженной симптоматикой, включая одновременно кровоточивость и тромбозы, что напоминает тромботическую тромбоцитопеническую пурпуру.
Чтобы избежать нежелательных последствий от такой терапии, важно помнить о профилактических мерах. Применение гепарина и тромболитиков следует сочетать с антиагрегантами (такими как ацетилсалициловая кислота, тиклид и другие). При комбинировании этих препаратов необходимо контролировать состояние пациента, поэтому мониторинг агрегатограммы и коагулограммы должен быть обязательным.
Видео: роль тромбофилии и иммунных нарушений в невынашивании беременности
Вопрос-ответ
Чем опасна генетическая тромбофилия?
Тромбофилия заметно повышает риск развития тромбоза глубоких вен, инсульта, инфаркта и других патологий, угрожающих жизни человека. Повышенная склонность к образованию тромбов также может стать причиной осложнений беременности.
Какова наиболее распространенная генетическая причина тромбофилии?
Фактор V Лейдена — наиболее распространённая наследственная форма тромбофилии. От 3 до 8% людей европейского происхождения несут в каждой клетке одну копию мутации фактора V Лейдена, а примерно у 1 из 5000 человек — две копии. В других популяциях эта мутация встречается реже.
Как лечить тромбофилию?
Лечение тромбофилии. Основная терапия направлена на введение лекарств, которые не позволяют тромбоцитам склеиваться между собой и формировать тромбы. Они называются антиагрегантами. При высоком риске развития тромбоза используются антикоагулянты, которые угнетающе действуют на процесс свертывания крови.
Почему возникает тромбофилия?
Причины появления тромбофилии. Таким образом, основной причиной тромбофилии становится дисбаланс свертывающих и противосвертывающих факторов крови, когда образование тромбов в сосудах происходит независимо от повреждения сосудистой стенки, а организм не может самостоятельно растворить их.
Советы
СОВЕТ №1
Обязательно проконсультируйтесь с врачом, если у вас есть семейная история тромбофилии или вы замечаете у себя симптомы, такие как отеки, боль в ногах или частые тромбы. Раннее выявление может значительно снизить риски осложнений.
СОВЕТ №2
Следите за своим образом жизни: поддерживайте активность, избегайте длительного сидения и старайтесь поддерживать здоровый вес. Физическая активность помогает улучшить кровообращение и снижает риск тромбообразования.
СОВЕТ №3
Если вам назначено лечение, строго следуйте рекомендациям врача и не прерывайте курс без консультации. Лекарства, такие как антикоагулянты, могут быть жизненно важными для предотвращения тромбообразования.
СОВЕТ №4
Регулярно проходите медицинские обследования и анализы, особенно если у вас есть предрасположенность к тромбофилии. Это поможет контролировать состояние и своевременно корректировать лечение.